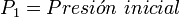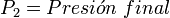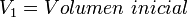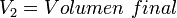Para entender los diferentes estados en los que la materia existe, es necesario entender algo llamado Teoría Molecular cinética de la Materia.
Uno de los conceptos básicos de la teoría argumenta que los átomos y moléculas poseen una energía de movimiento, que percibimos como temperatura. En otras palabras, los átomos y moléculas están en movimiento constante y medimos la energía de estos movimientos como la temperatura de una sustancia. Mientras más energía hay en una sustancia, mayor movimiento molecular y mayor la temperatura percibida. Consecuentemente, un punto importante es que la cantidad de energía que tienen los átomos y las moléculas (y por consiguiente la cantidad de movimiento) influye en su interacción.
¿Cómo se producen estos diferentes estados de la materia? Los átomos que tienen poca energía interactúan mucho y tienden a "encerrarse" y no interactuar con otros átomos.
Por consiguiente, colectivamente, estos átomos forman una sustancia dura, lo que llamamos un sólido. Los átomos que poseen mucha energía se mueven libremente, volando en un espacio y forman lo que llamamos gas.
Los gases se forman cuando la energía de un sistema excede todas las fuerzas de atracción entre moléculas. Así, las moléculas de gas interactúan poco, ocasionalmente chocándose. En el estado gaseoso, las moléculas se mueven rápidamente y son libres de circular en cualquier dirección, extendiéndose en largas distancias. A medida que la temperatura aumenta, la cantidad de movimiento de las moléculas individuales aumenta.
Los gases se expanden para llenar sus contenedores y tienen una densidad baja. Debido a que las moléculas individuales están ampliamente separadas y pueden circular libremente en el estado gaseoso, los gases pueden ser fácilmente comprimidos y pueden tener una forma indefinida.
El comportamiento de todos los gases se ajusta a tres leyes, las cuales relacionan el volumen de un gas con su temperatura y presión. Los gases que obedecen estas leyes son llamados gases ideales o perfectos.
En el siguiente informe estudiaremos la ley de Boyle y Mariotte y la ley de Charles y Gay-lussac.
PROCEDIMIENTO
Marco teórico
Propiedades de los gases
El estado gaseoso es un estado disperso de la materia, es decir, que las moléculas del gas están separadas unas de otras por distancias mucho mayores del tamaño del diámetro real de las moléculas. Resuelta entonces, que el volumen ocupado por el gas (V) depende de la presión (P), la temperatura (T) y de la cantidad o numero de moles (n).
1. Se adaptan a la forma y el volumen del recipiente que los contiene. Un gas, al cambiar de recipiente, se expande o se comprime, de manera que ocupa todo el volumen y toma la forma de su nuevo recipiente.
2. Se dejan comprimir fácilmente. Al existir espacios intermoleculares, las moléculas se pueden acercar unas a otras reduciendo su volumen, cuando aplicamos una presión.
3. Se difunden fácilmente. Al no existir fuerza de atracción intermolecular entre sus partículas, los gases se esparcen en forma espontánea.
4. Se dilatan, la energía cinética promedio de sus moléculas es directamente proporcional a la temperatura aplicada
Variables que afectan el comportamiento de los gases
1. PRESIÓN
Es la fuerza ejercida por unidad de área. En los gases esta fuerza actúa en forma uniforme sobre todas las partes del recipiente.
La presión atmosférica es la fuerza ejercida por la atmósfera sobre los cuerpos que están en la superficie terrestre. Se origina del peso del aire que la forma. Mientras más alto se halle un cuerpo menos aire hay por encima de él, por consiguiente la presión sobre él será menor.
En Física, llamamos presión a la relación que existe entre una fuerza y la superficie sobre la que se aplica:
P=FS
Dado que en el Sistema Internacional la unidad de fuerza es el newton (N) y la de superficie es el metro cuadrado (m2), la unidad resultante para la presión es el newton por metro cuadrado (N/m2) que recibe el nombre de pascal (Pa)
1Pa=1Nm2
2. TEMPERATURA
Es una medida de la intensidad del calor, y el calor a su vez es una forma de energía que podemos medir en unidades de calorías. Cuando un cuerpo caliente se coloca en contacto con uno frío, el calor fluye del cuerpo caliente al cuerpo frío.
La temperatura de un gas es proporcional a la energía cinética media de las moléculas del gas. A mayor energía cinética mayor temperatura y viceversa.
La temperatura de los gases se expresa en grados kelvin.
Según la teoría cinética, la temperatura es una medida de la energía cinética media de los átomos y moléculas que constituyen un sistema. Dado que la energía cinética depende de la velocidad, podemos decir que la temperatura está relacionada con las velocidades medias de las moléculas del gas.
Hay varias escalas para medir la temperatura; las más conocidas y utilizadas son las escalas Celsius (ºC), Kelvin (K) y Fahrenheit (ºF). En este trabajo sólo utilizaremos las dos primeras.
¿Cómo se calibra un termómetro?
Mientras se está produciendo un cambio de estado la temperatura permanece constante y por ello consideramos los cambios de estado del agua (a 1 atm) como puntos de referencia.
Punto de fusión del agua:
La fase líquida se encuentra en equilibrio con la fase sólida y la temperatura permanece constante.
Los valores otorgados a este punto en cada escala son:
- Celsius: 0
- Kelvin: 273.15
- Fahrenheit: 32
Punto de ebullición del agua:
La fase líquida se encuentra en equilibrio con la fase gaseosa y la temperatura permanece constante.
Los valores otorgados a este punto en cada escala son:
- Celsius: 100
- Kelvin: 373.15
- Fahrenheit: 212
|
En el intervalo de temperatura comprendido entre los puntos de fusión y ebullición, el agua permanece líquida. Este intervalo se divide en 100 partes en las escalas Celsius y Kelvin, mientras que en la escala Fahrenheit se divide en 180 partes.
Recuerda:
En los cálculos que vamos a realizar en este trabajo SIEMPRE habrá que expresar la temperatura en kelvin.
3. CANTIDAD
La cantidad de un gas se puede medir en unidades de masa, usualmente en gramos. De acuerdo con el sistema de unidades SI, la cantidad también se expresa mediante el número de moles de sustancia, esta puede calcularse dividiendo el peso del gas por su peso molecular.
4. VOLUMEN
Es el espacio ocupado por un cuerpo.
5. DENSIDAD
Es la relación que se establece entre el peso molecular en gramos de un gas y su volumen molar en litros.
Gas Real
Los gases reales son los que en condiciones ordinarias de temperatura y presión se comportan como gases ideales; pero si la temperatura es muy baja o la presión muy alta, las propiedades de los gases reales se desvían en forma considerable de las de gases ideales.
Concepto de Gas Ideal y diferencia entre Gas Ideal y Real.
Los Gases que se ajusten a estas suposiciones se llaman gases ideales y aquellas que no, se les llaman gases reales, o sea, hidrógeno, oxígeno, nitrógeno y otros.
1. - Un gas está formado por partículas llamadas moléculas.
Dependiendo del gas, cada molécula está formada por un átomo o un grupo de átomos. Si el gas es un elemento o un compuesto en su estado estable, consideramos que todas sus moléculas son idénticas.
2. - Las moléculas se encuentran animadas de movimiento aleatorio y obedecen las leyes de Newton del movimiento. Las moléculas se mueven en todas direcciones y a velocidades diferentes.Se puede aplicar en el nivel microscópico. Como para todas nuestras suposiciones, esta mantendrá o desechara, dependiendo de sí los hechos experimentales indican o no que nuestras predicciones son correctas.
3. - El número total de moléculas es grande. La dirección y la rapidez del movimiento de cualquiera de las moléculas pueden cambiar bruscamente en los choques con las paredes o con otras moléculas. Cualquiera de las moléculas en particular, seguirá una trayectoria de zigzag, debido a dichos choques. Sin embargo, como hay muchas moléculas, suponemos que el gran número de choques resultante mantiene una distribucion total de las velocidades moleculares con un movimiento promedio aleatorio.
4. - El volumen de las moléculas es una fracción despreciablemente pequeña del volumen ocupado por el gas. Aunque hay muchas moléculas, son extremadamente pequeñas. Sabemos que el volumen ocupado por una gas se puede cambiar en un margen muy amplio, con poca dificultad y que, cuando un gas se condensa, el volumen ocupado por el gas comprimido hasta dejarlo en forma líquida puede ser miles de veces menor. Por ejemplo, un gas natural puede licuarse y reducir en 600 veces su volumen.
5. - No actúan fuerzas apreciables sobre las moléculas, excepto durante los choques. En el grado de que esto sea cierto, una molécula se moverá con velocidad uniformemente los choques. Como hemos supuesto que las moléculas sean tan pequeñas, la distancia media entre ellas es grande en comparación con el tamaño de una de las moléculas. De aquí que supongamos que el alcance de las fuerzas moleculares es comparable al tamaño molecular.
6. - Los choques son elásticos y de duración despreciable. En los choques entre las moléculas con las paredes del recipiente se conserva el ímpetu y (suponemos) la energía cinética. Debido a que el tiempo de choque es despreciable comparado con el tiempo que transcurre entre el choque de moléculas, la energía cinética que se convierte en energía potencial durante el choque, queda disponible de nuevo como energía cinética, después de un tiempo tan corto, que podemos ignorar este cambio por completo.
Leyes de los gases ideales
La Ley de Boyle-Mariotte (o Ley de Boyle), formulada por Robert Boyle y Edme Mariotte, es una de las leyes de los gases ideales que relaciona el volumen y la presión de una cierta cantidad de gas mantenida a temperatura constante. La ley dice que el volumen es inversamente proporcional a la presión:
Donde 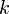 es constante si la temperatura y la masa del gas permanecen constantes.
es constante si la temperatura y la masa del gas permanecen constantes.
Cuando aumenta la presión, el volumen disminuye, mientras que si la presión disminuye el volumen aumenta. No es necesario conocer el valor exacto de la constante 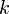 para poder hacer uso de la ley: si consideramos las dos situaciones de la figura, manteniendo constante la cantidad de gas y la temperatura, deberá cumplirse la relación:
para poder hacer uso de la ley: si consideramos las dos situaciones de la figura, manteniendo constante la cantidad de gas y la temperatura, deberá cumplirse la relación:
Donde:
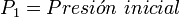
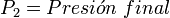
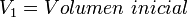
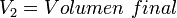

Para describir el comportamiento de una masa gaseosa, es conveniente tener información acerca del volumen que ocupa, así como, de su presión y su temperatura. Es difícil expresar en una ecuación la relación entre la presión, el volumen y la temperatura de una cantidad cualquiera de gas. Sólo cuando la densidad ( o presión) de los gases reales es baja es posible sintetizar los resultados experimentales en tres leyes: la ley de Boyle - Mariotte, la ley de Charles – Gay Lussac, y la ley de Avogadro. Estas tres leyes, sin embargo, sólo son casos particulares del comportamiento de los gases en estas condiciones (baja densidad y baja presión); el cual está gobernado por la ecuación de estado del gas ideal.


La ley de Boyle establece que la presión de un gas en un recipiente cerrado es inversamente proporcional al volumen del recipiente, cuando la temperatura es constante.
El volumen es inversamente proporcional a la presión:
- Si la presión aumenta, el volumen disminuye.
- Si la presión disminuye, el volumen aumenta.
¿Por qué ocurre esto?
Al aumentar el volumen, las partículas (átomos o moléculas) del gas tardan más en llegar a las paredes del recipiente y por lo tanto chocan menos veces por unidad de tiempo contra ellas. Esto significa que la presión será menor ya que ésta representa la frecuencia de choques del gas contra las paredes.
Cuando disminuye el volumen la distancia que tienen que recorrer las partículas es menor y por tanto se producen más choques en cada unidad de tiempo: aumenta la presión.
Lo que Boyle descubrió es que si la cantidad de gas y la temperatura permanecen constantes, el producto de la presión por el volumen siempre tiene el mismo valor.
Como hemos visto, la expresión matemática de esta ley es:
P⋅V=k
P⋅V=k
(el producto de la presión por el volumen es constante)
Supongamos que tenemos un cierto volumen de gas V1 que se encuentra a una presión P1 al comienzo del experimento. Si variamos el volumen de gas hasta un nuevo valor V2, entonces la presión cambiará a P2, y se cumplirá:
P1⋅V1=P2⋅V2


En 1787, Jack Charles estudió por primera vez la relación entre el volumen y la temperatura de una muestra de gas a presión constante y observó que cuando se aumentaba la temperatura el volumen del gas también aumentaba y que al enfriar el volumen disminuía.
El volumen es directamente proporcional a la temperatura del gas:
- Si la temperatura aumenta, el volumen del gas aumenta.
- Si la temperatura del gas disminuye, el volumen disminuye.
¿Por qué ocurre esto?
Cuando aumentamos la temperatura del gas las moléculas se mueven con más rapidez y tardan menos tiempo en alcanzar las paredes del recipiente. Esto quiere decir que el número de choques por unidad de tiempo será mayor. Es decir se producirá un aumento (por un instante) de la presión en el interior del recipiente y aumentará el volumen (el émbolo se desplazará hacia arriba hasta que la presión se iguale con la exterior).
Lo que Charles descubrió es que si la cantidad de gas y la presión permanecen constantes, el cociente entre el volumen y la temperatura siempre tiene el mismo valor.
Matemáticamente podemos expresarlo así:
VT=k
(el cociente entre el volumen y la temperatura es constante)
Supongamos que tenemos un cierto volumen de gas V1 que se encuentra a una temperatura T1 al comienzo del experimento. Si variamos el volumen de gas hasta un nuevo valor V2, entonces la temperatura cambiará a T2, y se cumplirá:
V1T1=V2T2
V1T1=V2T2
que es otra manera de expresar la ley de Charles.
Esta ley se descubre casi ciento cuarenta años después de la de Boyle debido a que cuando Charles la enunció se encontró con el inconveniente de tener que relacionar el volumen con la temperatura Celsius ya que aún no existía la escala absoluta de temperatura.

Este proceso es también conocido como isométrico, o isovolumétrico, pues es el proceso termodinámico donde el volumen, en todo momento, permanece constante,ΔV=0.
Durante este proceso el volumen es constante, el gas absorbe una cantidad de calor, aumentando por ende su temperatura hasta un valor final o en caso contrario; un gas se enfría desde una temperatura inicial hasta una
temperatura final manteniendo su volumen constante y disipando una cantidad de calor
En la figura, si un gas confinado en un cilindro provisto de un pistón, se calienta y se impide que se desplace el pistón, por ejemplo, sujetándolo mediante unos topes, se observan los siguientes cambios:
El volumen del gas permanecerá constante
La presión del gas se incrementará.
La temperatura se incrementa.

Se puede demostrar que en un proceso a volumen constante la densidad es proporcional a la masa molar (M).
Avogadro observó que si se colocaban masas de gases iguales a su masa molecular, a la misma temperatura y presión, todos ocupaban el mismo volumen.
En condiciones estándar de presión y temperatura (P = 1 atm y T = 273 K), el volumen ocupado es de 22.4 l, como se muestra en la siguiente figura:

O tra manera de expresar la Ley de Avogadro, es como sigue: volúmenes iguales de gases diferentes, bajo las mismas condiciones de temperatura y presión, contienen el mismo número de partículas y, por lo tanto, el mismo número de moles.
tra manera de expresar la Ley de Avogadro, es como sigue: volúmenes iguales de gases diferentes, bajo las mismas condiciones de temperatura y presión, contienen el mismo número de partículas y, por lo tanto, el mismo número de moles.
Es decir a presión y volumen constante un gas ocupa un volumen directamente proporcional al número de moléculas (N)



Se define como un mol a la cantidad de una sustancia cuya masa es numéricamente igual a la de una molécula de la misma


Donde el número de moléculas es igual al numero de moles por el numero de avogadro o masa en gramos es igual al numero de moles por la masa molar
A condiciones normales (1 atm y 25 oC) un gas ocupa 22.4 litros y contiene 6,022 x 10 23 moléculas. ( NA = 6,022 x 10 23)
Dado que el numero de moléculas es muy alto se suele expresar en términos de una cantidad fija de moléculas llamada mol (n)
1mol 0 6,022 x 10 23 moléculas.

Dado una masa m de un gas a densidades bajas y presión baja en un estado de equilibrio, las variables termodinámicas; presión, volumen y temperatura están relacionadas entre si con ayuda de las leyes de estado estudiadas anteriormente, con una ecuación llamada “ecuación de los gases ideales”
En la transformación isotérmica la densidad es proporcional a la presión
En la transformación isobárica la densidad es inversamente proporcional a la temperatura


- En la transformación isométrica la densidad es proporcional a la masa molar


Donde :
n es el numero de moles
es el numero de moles
R es la constante para los gases ideales cuyo valor es

N es el numero de moléculas igual a N = n Na
es el numero de moléculas igual a N = n Na
Na es el numero de Avogadro con valor
La ecuación de los gases ideales pueden ser sintetizadas por las ecuaciones
PV = n R T ó PV = N K T
LEY COMBINADA DE LOS GASES
La ley general de los gases o ley combinada dice que una masa de un gas ocupa un volumen que está determinado por la presión y la temperatura de dicho gas. Estudia el comportamiento de una determinada masa de gas si ninguna de esas magnitudes permanece constante.
Esta ley se emplea para todos aquellos gases ideales en los que el volumen, la presión y la temperatura no son constantes. Además la masa no varía. La fórmula de dicha ley se expresa: (V1 * P1) / T1 = (V2 * P2) / T2 Es decir, el volumen de la situación inicial por la presión original sobre la temperatura es igual a el volumen final por la nueva presión aplicada sobre la temperatura modificada.
La presión es una fuerza que se ejerce por la superficie del objeto y que mientras más pequeña sea ésta, mayor presión habrá
A partir de la ley combinada podemos calcular la forma como cambia el volumen o presión o temperatura si se conocen las condiciones iniciales (Pi,Vi,Ti) y se conocen dos de las condiciones finales (es decir, dos de las tres cantidades Pt, Vt, Tf
LEY DE GAY - LUSSAC
Relación entre la presión y la temperatura de un gas cuando el volumen es constante
Fue enunciada por Joseph Louis Gay-Lussac a principios de 1800.
Establece la relación entre la temperatura y la presión de un gas cuando el volumen es constante.
La presión del gas es directamente proporcional a su temperatura:
- Si aumentamos la temperatura, aumentará la presión.
- Si disminuimos la temperatura, disminuirá la presión.
¿Por qué ocurre esto?
Al aumentar la temperatura las moléculas del gas se mueven más rápidamente y por tanto aumenta el número de choques contra las paredes, es decir aumenta la presión ya que el recipiente es de paredes fijas y su volumen no puede cambiar.
Gay-Lussac descubrió que, en cualquier momento de este proceso, el cociente entre la presión y la temperatura siempre tenía el mismo valor:
PT=k
(el cociente entre la presión y la temperatura es constante)
Supongamos que tenemos un gas que se encuentra a una presión P1 y a una temperatura T1 al comienzo del experimento. Si variamos la temperatura hasta un nuevo valor T2, entonces la presión cambiará a P2, y se cumplirá:
P1T1=P2T2
P1T1=P2T2
que es otra manera de expresar la ley de Gay-Lussac.
Esta ley, al igual que la de Charles, está expresada en función de la temperatura absoluta. Al igual que en la ley de Charles, las temperaturas han de expresarse en Kelvin.
ESTADOS DE AGREGACIÓN
Los estados de agregación, sólido, líquido y gaseoso, dependen fundamentalmente de las condiciones de presión y temperatura a las que esté sometida la materia.
-En el estado sólido los átomos o moléculas ocupan posiciones fijas aunque se encuentran vibrando en esas posiciones con una capacidad de movimiento limitada.
En el estado líquido la fuerza de cohesión que mantiene unidas a las moléculas es mucho menor.
En un líquido las moléculas tienen una cierta capacidad de movimiento que, en gran medida, está limitada por las otras moléculas que tienen alrededor.
En un gas las moléculas se encuentran muy lejanas unas de otras y se mueven en todas direcciones con libertad absoluta.
DESARROLLO LABORATORIO
LEY DE AVOGADRO
LEY DE BOYLE
LEY DE CHARLES
LEY DE GASES IDEALES

 (convergiendo hacia un volumen muy pequeño) y estén centrados alrededor de un punto, siendo
(convergiendo hacia un volumen muy pequeño) y estén centrados alrededor de un punto, siendo  la masa contenida en cada uno de los volúmenes anteriores, la densidad en el punto común a todos esos volúmenes:
la masa contenida en cada uno de los volúmenes anteriores, la densidad en el punto común a todos esos volúmenes: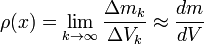

 (convergiendo hacia un volumen muy pequeño) y estén centrados alrededor de un punto, siendo
(convergiendo hacia un volumen muy pequeño) y estén centrados alrededor de un punto, siendo  la masa contenida en cada uno de los volúmenes anteriores, la densidad en el punto común a todos esos volúmenes:
la masa contenida en cada uno de los volúmenes anteriores, la densidad en el punto común a todos esos volúmenes: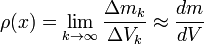


















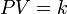
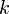 es constante si la temperatura y la masa del gas permanecen constantes.
es constante si la temperatura y la masa del gas permanecen constantes.